赛力特蓄电池工作原理
赛力特蓄电池工作原理
1.赛力特蓄电池是一种将化学能与电能互相转换的装置。
2.在充电时,电能转换为化学能,正极上的硫酸铅失去两个电子后转变成二氧化铅,失去的电子通过外线路上的负载转移到负极上,负极上的硫酸铅得到两个电子后转变成海绵状铅(Pb)。
3.在放电时,化学能转换为电能,整个过程正好相反。
4.上述过程用化学反应方程式表示即为:
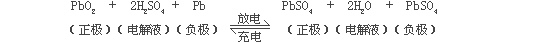
对常规铅酸蓄电池,在蓄电池充电后期,充入的电流主要消耗在电解液中水的分解,导致在蓄电池的正极产生氧气,在负极产生氢气。这些气体从蓄电池中不断逸出,会导致电解液逐渐失水,从而导致蓄电池性能下降,甚至电池干涸。因此常规蓄电池需要定期补加水。
阀控密封铅酸蓄电池采用密封技术(或氧气再化合技术),即在设计上抑制氢气的析出,同时,使蓄电池充电后期产生的氧气在内部几乎完全再化合,无
剩余气体排放。电池几乎不失水,因此该电池在整个使用过程中不需补加水。
赛力特蓄电池充电后期以前的过程和常规铅酸蓄电池基本一样。但在蓄电池充电末期或过充电过程中,赛力特蓄电池充入的电量基本用于氧气的再化合过程,此时在电池内发生的氧气再化合反应如下:
(1) 正极上的反应(氧气的产生)
2H2O → O2 + 4H+ + 4e- ①
在正极产生的氧气,穿过超细玻璃纤维(AGM)隔膜到达负极表面并在负极发生一系列反应。
(2) 负极上的反应
2Pb + O2 → 2PbO ②
2PbO + 2H2SO4 → 2PbSO4 + 2H2O ③
2PbSO4 + 4H+ + 4e- → 2Pb + 2H2SO4 ④
负极上总的反应为
O2 + 4H+ + 4e- →2H2O ⑤
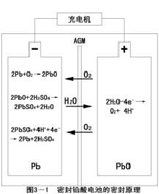
通过以上反应,在正极上产生的氧气穿过超细玻璃纤维隔膜(AGM)传输到负极,完全被负极所吸收;正极上所消耗的水(电解液),在负极上的反应③中又重新生成,穿过隔膜又回到正极(如图3-1所示),完成了H2O→O2→H20循环。负极活性物质经过一系列的反应,也完成了Pb→PbO→PbSO4→Pb的循环。使电池内多余的气体产生和净的物质(H2O、O2、Pb、PbO、PbSO4)生成。因此,电池不需要补加水,可以密封免维护。由于在不正常使用等特殊情况下,电池内反应平衡可能被打破,可能产生少量多余的气体,电池装有安全阀,当电池内气压超过
一定数值时,安全阀开启,以便将多余气体排出;当电池内气压低于一定气压时,安全阀自动关闭,以隔绝电池外部气体进入,故该类电池又称阀控式密封铅酸赛力特蓄电池。
- 上一篇:赛力特蓄电池设计要点 2020/6/3
- 下一篇:赛力特蓄电池产品特性 2020/6/3
